Przeszczep rogówki Profilaktyka odrzucania u biorców wysokiego ryzyka
Celem przeszczepienia rogówki jest uzyskanie jej przezierności i odpowiednich właściwości optycznych. Najczęstszą przyczyną utraty przezierności przeszczepu rogówki jest wystąpienie immunologicznej reakcji odrzucania, co określane jest mianem choroby przeszczepu rogówki.
W tym roku mija 110 lat od pierwszego udanego przeszczepienia rogówki u człowieka. Obecnie w Polsce wykonuje się około 900 takich zabiegów rocznie, dla porównania w Stanach Zjednoczonych około 59000 rocznie. Tak duża liczba wykonywanych zabiegów wiąże się z dobrym rokowaniem i skuteczną rekonwalescencją wzrokową u większości chorych.
Wskazania do przeszczepu
Najczęstszym wskazaniem do przeszczepienia rogówki jest rozpoznanie dystrofii śródbłonkowej Fuchsa, keratopatii pęcherzowej i stożka rogówki. Po 10 latach od zabiegu w tych grupach chorych przeziernych pozostaje aż 40-92 proc. przeszczepów, dlatego określamy ich mianem biorców niskiego ryzyka. Warto w tym miejscu zaznaczyć, że u biorców rogówek nie oznacza się antygenów zgodności tkankowej, a w postępowaniu pooperacyjnym miejscowo stosowane krople steroidowe najczęściej skutecznie zapobiegają wystąpieniu reakcji odrzucania (w naszym ośrodku stosuje się je do czasu zdjęcia szwów – czyli około roku, ponieważ ich usuwanie wiąże się ze zwiększonym ryzykiem wystąpienia choroby przeszczepu rogówki; są jednak ośrodki, gdzie krople stosowane są tylko sześć miesięcy po zabiegu) (Zdjęcie 1).
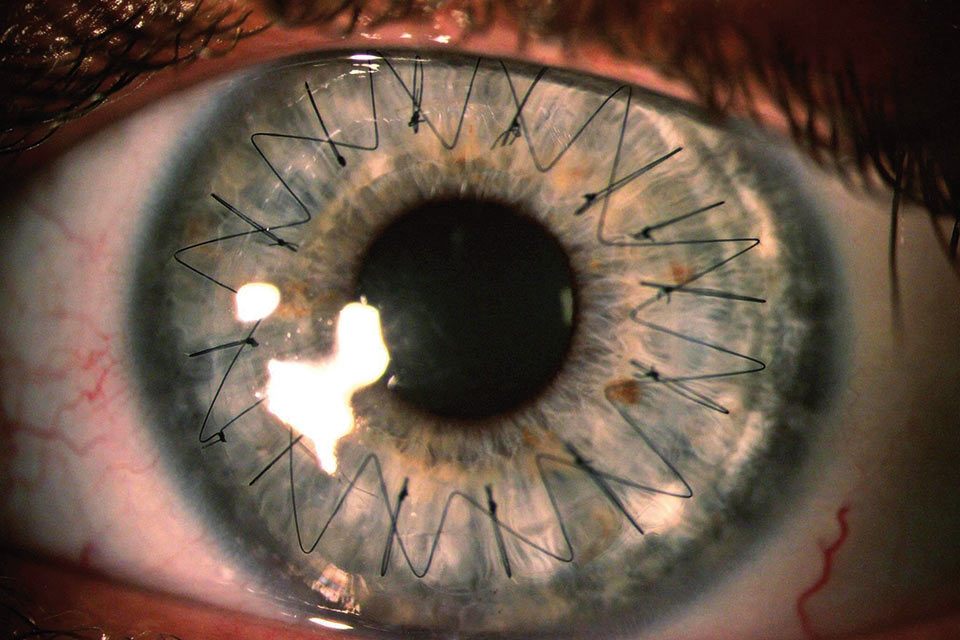
Zdjęcie 1. Przezierny przeszczep rogówki u biorcy niskiego ryzyka (operowanego z powodu stożka rogówki). Widoczne szwy pojedyncze i szew ciągły. (materiał SPKSO)
Jest to możliwe dzięki uprzywilejowaniu immunologicznemu tkanek gałki ocznej. Jest to pojęcie wprowadzone 65 lat temu przez dwóch niezależnych badaczy Sir Petera Briana Medawara (laureata nagrody Nobla w dziedzinie fizjologia/medycyna w 1965 roku) i Ruperta Billinghama, którzy zauważyli, że allogeniczny przeszczep skóry do komory przedniej oka nie jest szybko odrzucany i utrzymuje się zaskakująco długo. Uzasadniano to wówczas brakiem naczyń krwionośnych i limfatycznych w rogówce, dzięki czemu była ona izolowana od układu immunologicznego.
Dopiero w latach 80. XX wieku J. Wayne Streilein i Henry J. Kaplan udowodnili, że przywilej immunologiczny nie jest związany z izolacją tkanek oka od układu immunologicznego, a stanowi złożony proces wytwarzania środowiska immunosupresyjnego, dzięki czemu tak istotne dla przeżycia danego gatunku struktury (gałka oczna, mózg, jajniki, jądra, ciężarna macica) nie ulegają samozniszczeniu w przebiegu niekontrolowanego procesu zapalnego. Eliminacja obcego antygenu czy też komórek nowotworowych wprowadzonych do skóry przebiega szybko i pozostawia po sobie blizny, które nie wpływają na funkcjonowanie organizmu, natomiast w oku niekontrolowany przebieg takiego procesu spowodowałby ciężkie uszkodzenie i prawdopodobnie ślepotę. Ma to też swoje konsekwencje (jest rodzaj niebezpiecznego kompromisu), ponieważ wprowadzone komórki nowotworowe (np. siatkówczaka) nie są tu eliminowane, tak jak ma to miejsce w skórze, co prowadzi do rozwoju guzów nowotworowych.
Mechanizm tworzący przywilej immunologiczny
Obecnie uważa się, że w skład mechanizmów tworzących przywilej immunologiczny wchodzą: bariera anatomiczna (brak naczyń krwionośnych i limfatycznych oraz szczelne połączenia komórkowe między komórkami nabłonka barwinkowego siatkówki i śródbłonka naczyń), brak ekspresji MHC klasy II i zmniejszona ekspresja MHC klasy I na komórkach rogówki, obecność niedojrzałych form komórek prezentujących antygen, immunosupresyjne środowisko, które tworzą cytokiny rozpuszczone w cieczy wodnistej i związane z błonami komórkowymi (m.in. indukują apoptozę aktywowanych limfocytów T, neutrofili, modulują funkcje komórek prezentujących antygen, komórek NK, hamują funkcje prozapalne makrofagów, limfocytów Th1, limfocytów T regulatorowych) oraz odmienność immunologiczna związana z komorą przednią (anterior chamber-associated immune deviation, ACAID). ACAID jest to szereg procesów (biorą w nich udział śledzona i grasica) wywołanych przez obecność obcego antygenu w komorze przedniej oka, które prowadzą do powstania limfocytów T regulatorowych, odpowiadających za zahamowanie odpowiedzi immunologicznej na obcy antygen (hamują różnicowanie limfocytów Th1 w węzłach chłonnych, hamują funkcje efektorowych limfocytów Th1 i Th2 w tkance docelowej, hamują opóźnioną odpowiedź typu komórkowego).
W przypadku biorców rogówki wysokiego ryzyka ze względu na utratę przywileju immunologicznego rokowanie jest znacznie gorsze niż u biorców niskiego ryzyka. Pierwsze publikacje dotyczące czynników kwalifikujących biorcę do grupy wysokiego ryzyka pojawiły się w latach 70. XX wieku. Zaczęto wówczas zwracać uwagę na wpływ braku zgodności tkankowej na rokowanie w tej grupie chorych. W jednej z pierwszych opublikowanych wówczas prac zauważono, że mimo niezgodności antygenowej u biorców niskiego ryzyka (bez unaczynienia rogówki) po roku od przeszczepienia 85 proc. przeszczepów pozostało przeziernych, podczas gdy w grupie wysokiego ryzyka (z neowaskularyzacją rogówki) – jedynie 33 proc. (Zdjęcie 2).
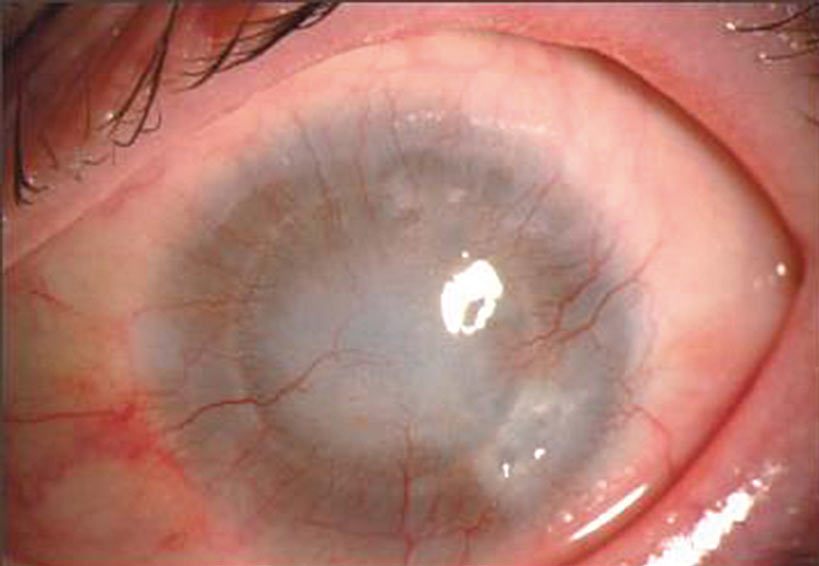
Zdjęcie 2. Biorca wysokiego ryzyka zakwalifikowany do zabiegu retransplantacji (stan po przeszczepieniu rogówki z powodu ciężkiego opornego na leczenie zapalenia bakteryjnego). Widoczne przymglenie przeszczepu i neowaskularyzacja. (materiał SPKSO)
Czynniki ryzyka
Neowaskularyzacja rogówki przed przeszczepieniem jest uważna za jeden z najważniejszych czynników ryzyka utraty przywileju immunologicznego i utraty przezierności przeszczepu w wyniku reakcji odrzucania. Im więcej unaczynionych kwadrantów rogówki, tym większe ryzyko wystąpienia choroby przeszczepu. Obecność głębokiego unaczynienia w więcej niż dwóch kwadrantach kwalifikuje biorcę do grupy wysokiego ryzyka.
Drugim równie ważnym czynnikiem ryzyka jest ponowy przeszczep. Im więcej razy przeszczepiana była rogówka w danym oku, tym większe ryzyko wystąpienia choroby przeszczepu i utraty jego przezierności, zwłaszcza, jeśli przyczyną utraty wcześniejszych przeszczepów była reakcja odrzucania.
Trzecim najbardziej istotnym czynnikiem ryzyka wystąpienia choroby przeszczepu jest obecność stanu zapalnego (aktywnego owrzodzenia mogącego prowadzić do perforacji rogówki czy przewlekłego lub aktywnego nawracającego zapalenia błony naczyniowej), który znosi przywilej immunologiczny.
Ponadto przeszczepienie rogówki u dzieci jest obarczone wyższym ryzykiem wystąpienia choroby przeszczepu rogówki niż tego typu zabieg u dorosłych i dlatego dzieci uważane są za biorców rogówki wysokiego ryzyka. Uważa się, że jest to związane z inwolucją grasicy oraz uszkodzeniem subpopulacji limfocytów u dorosłych.
Prowadzone badania mówią także o niekorzystnym wpływie dużej średnicy przeszczepu (znajduje się on bliżej unaczynionego i bogatego w komórki prezentujące antygen rąbka rogówki), atopii i alergicznego zapalenia spojówek, wcześniejszych zabiegów (lensektomia, witrektomia), obecności implantów drenujących, zrostów tęczówkowo-rogówkowych oraz pooperacyjnie obecność luźnych szwów na rogówce (drażnią jej powierzchnię i są przyczyną wrastania naczyń oraz zwiększonej ekspresji MHC).
Szczególnym rodzajem przeszczepu jest przeszczep rąbkowy, ponieważ w tym przypadku przeszczepiana jest tkanka unaczyniona. Rąbek rogówki znajduje się między rogówką a twardówką, i obecne są tam komórki pluripotencjalne (komórki macierzyste rąbka) niezbędne do zachowania prawidłowej powierzchni rogówki (odnowy komórek nabłonka rogówki). Utrata czy niewydolność komórek macierzystych prowadzi do zaburzeń odnowy nabłonka rogówki, jej unaczynienia, narastania spojówki na rogówkę i nierzadko utarty użytecznej ostrości wzroku. Do uszkodzenia komórek rąbka dochodzi m.in. podczas oparzeń chemicznych i termicznych, w zespole Stevens-Johnsona, pemfigoidzie ocznym. W takich przypadkach wykonywany jest najpierw przeszczep rąbka rogówki, a zwykle w drugim etapie przeszczep drążący rogówki.
Ze względu na gorsze rokowanie (w ciągu pierwszego roku od zabiegu odrzucanych jest 40-70 proc. przeszczepów rogówek), postępowanie u biorców wysokiego ryzyka wymaga stosowania bardziej intensywnego leczenia zabezpieczającego przed wystąpieniem choroby przeszczepu rogówki (Zdjęcie 3).
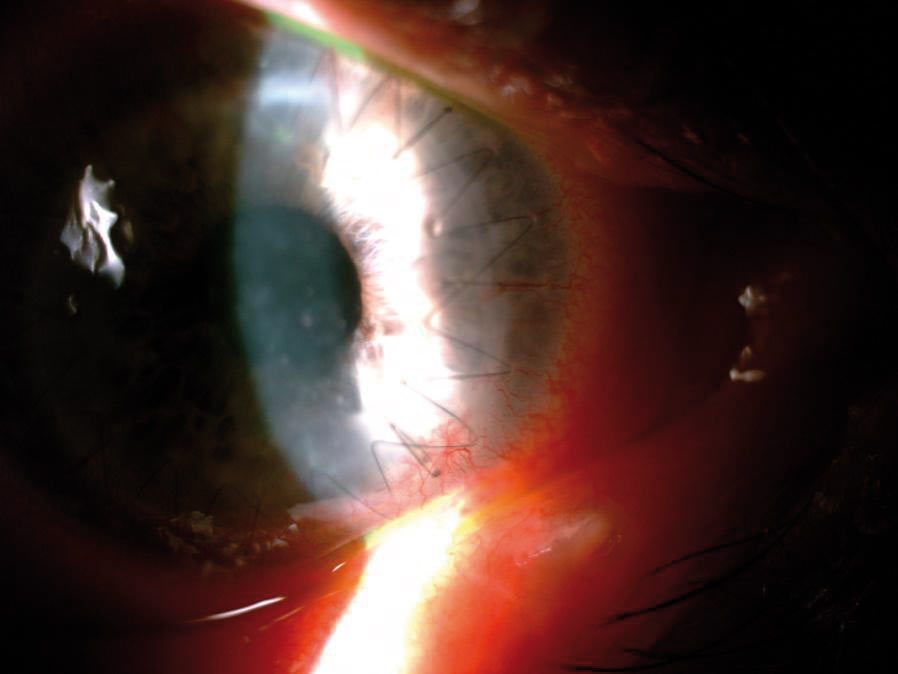
Zdjęcie 3. Choroba przeszczepu rogówki u pacjenta po przeszczepieniu z powodu perforacji w przebiegu owrzodzenia rogówki. Widoczne przymglenie przeszczepu, jego obrzęk i liczne osady na śródbłonku rogówki. (materiał SPKSO)
Leki immunosupresyjne
Już w latach 70. XX wieku zwrócono uwagę na możliwość doboru zgodnych antygenowo dawców i biorców rogówek wysokiego ryzyka. Jednak wyniki opublikowanych do tej pory badań są niejednoznaczne. Choć większość badaczy wskazuje na korzyści wynikające z oznaczania HLA, były one prowadzone na małych grupach chorych, zwykle bez grup kontrolnych i mały charakter retrospektywny. Nie jest to postępowanie standardowe w ośrodkach na świecie ani w Polsce. Ponadto w Polsce dobór pacjentów pod względem zgodności antygenowej wydłużyłby i tak długi czas oczekiwania na zabieg (w naszym ośrodku na zabieg oczekuje obecnie 1600 biorców, a rocznie wykonywanych jest około 200 przeszczepień).
Dlatego też, kiedy w latach 80. XX wieku zaczęto stosować cyklosporynę A (CsA) w transplantologii, wykorzystano ją również w okulistyce.
Celem stosowania profilaktycznej ogólnej immunosupresji jest zapobieganie występowaniu ostrego odrzucania przy jednoczesnym odstawieniu steroidów lub stosowaniu ich w najmniejszej skutecznej dawce.
Ogólnie stosowana CsA okazała się lekiem skutecznie zapobiegającym utracie przezierności przeszczepu rogówki w wyniku ostrego odrzucania. Po roku obserwacji utrata przezierności w grupie biorców wysokiego ryzyka wynosiła 0-8 proc., a po trzech latach u 23-31 proc. pacjentów. Jednak jest to lek powodujący wystąpienie istotnych działań niepożądanych, takich jak nadciśnienie tętnicze, uszkodzenie nerek, wątroby, nowotworzenie. Dlatego też konieczne jest monitorowanie poziomu leku we krwi, aby utrzymać stężenie bezpieczne, a jednocześnie skutecznie zapobiegające wystąpieniu choroby przeszczepu rogówki. Takrolimus, podobnie jak CsA, stosowany jest rzadko ze względu na potencjalne działania niepożądane.
W naszym ośrodku od 2009 roku w profilaktyce odrzucania przeszczepu rogówki u biorców wysokiego ryzyka stosujemy mykofenolan mofetylu (MMF). Jest to jedyny lek immunosupresyjny wykorzystywany w profilaktyce odrzucania przeszczepu rogówki, w stosunku do którego przeprowadzono kontrolowane, randomizowane badania kliniczne[1].
W naszym ośrodku u biorców rogówki wysokiego ryzyka dzień przed zabiegiem włączamy MMF oraz dodatkowo w dniu zabiegu i przez kolejne dwa dni podawany jest dożylnie metylprednizolon, który od czwartego dnia po zabiegu stosujemy doustnie. W dniu wypisu lub po tygodniu od zabiegu oceniamy poziom kwasu mykofenolowego (MPA) i ewentualnie modyfikujemy dawkę leku, aby uzyskać poziom terapeutyczny leku w surowicy krwi (C0 2-5 ng/ml). W przypadku dobrej odpowiedzi na leczenie po około miesiącu dawka MMF jest zmniejszana i po roku lek ten jest odstawiany. Z kolei dawka metylprednizolonu redukowana jest stopniowo w ciągu pierwszych dwóch miesięcy, a następnie stosowana jest najmniejsza skuteczna dawka leku i około miesiąca przed planowanym zakończeniem leczenia immunosupresyjnego, steryd jest odstawiany.
Ze względu na możliwość reaktywacji zakażeń bakteryjnych i wirusowych stosowana jest także profilaktyka przeciwwirusowa, czyli acyklowir doustnie przez 6 miesięcy oraz profilaktyka przeciwbakteryjna (możliwość indukcji zakażeń atypowych) w postaci kotrimazolu (również przez 6 miesięcy).
Skuteczne leczenie
Wyniki prowadzonych przez nas badań (oczekujących na publikację) dowodzą wysokiej skuteczności stosowanego leczenia. Na ryc. 1 przedstawiono krzywą Kaplana-Maiera porównującą skuteczność opisanego wyżej schematu leczenia w grupie biorców wysokiego ryzyka do ogólnej sterydoterapii. Grupę badaną stanowiło 98 prospektywnie ocenianych pacjentów spełniających kryteria włączenia, u których zastosowano profilaktycznie mykofenolan mofetylu i steroid ogólnie (obok miejscowo stosowanych steroidów). Grupę kontrolną stanowiło 98 retrospektywnie ocenianych chorych spełniających kryteria włączenia, u których zastosowano ogólną i miejscową sterydoterapię po przeszczepieniu rogówki. W ciągu 24 miesięcy obserwacji w grupie badanej u 8 osób (8 proc.) wystąpiło ostre odrzucanie przeszczepu, a u 3 (3 proc.) z nich doszło do trwałej utraty przezierności przeszczepu rogówki. W grupie kontrolnej choroba przeszczepu wystąpiła u 76 (78 proc.) osób, a u 30 (31 proc.) z nich doszło do trwałej utraty przezierności przeszczepu rogówki. Analiza regresji Coxa wykazała, że stosowanie mykofenolanu mofetylu w profilaktyce wystąpienia choroby przeszczepu rogówki 11-krotnie zmniejsza ryzyko wystąpienia ostrego odrzucania (RR = 11, 95.0% CI 4.8–25, p < 0.0001). W grupie badanej u 13 osób wystąpiły dolegliwości ze strony przewodu pokarmowego, u 3 wystąpiła leukopenia, a u 2 anemia (dolegliwości zmniejszyły się po redukcji dawki myfenolanu mofetylu, a parametry morfologii krwi wróciły do normy). U jednej pacjentki zakończono leczenie po 6 miesiącach ze względu na uporczywą biegunkę. Nie miało to jednak wpływu na skuteczność terapii, ponieważ w ciągu całego okresu obserwacji nie wystąpił u chorej epizod odrzucania, a przeszczep pozostał przezierny.
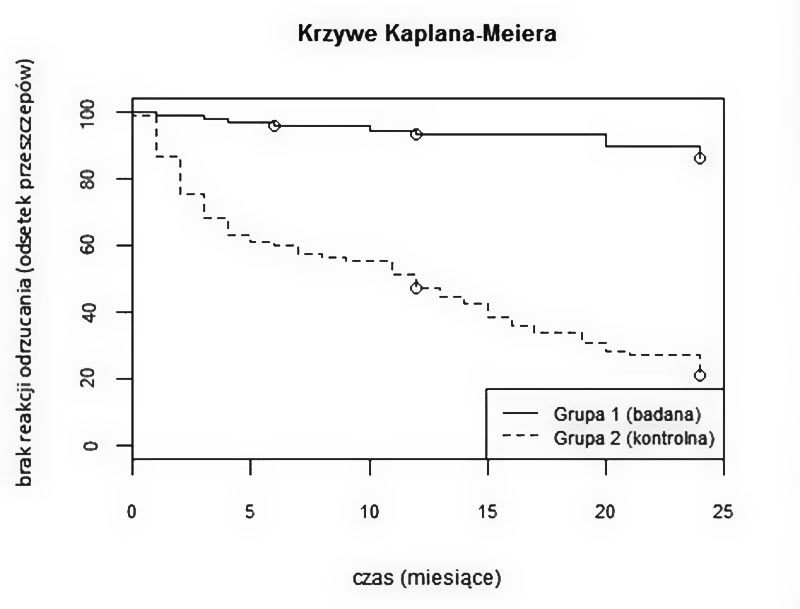
Rycina 1. Krzywa Kaplana-Meiera przedstawiająca odsetek przeszczepów rogówki, w których nie wystąpiły choroby przeszczepu w czasie obserwacji.
W przypadku przeszczepu rąbkowego wykorzystywana jest unaczyniona tkanka, dlatego też po zabiegu stosuje się trójlekową immunosupresję, podobnie jak po przeszczepach narządów unaczynionych.
Holland i współpracownicy w 2012 roku opublikowali wyniki swoich 10-letnich badań dotyczących zastosowania ogólnej trójlekowej immunosupresji u biorców rąbka rogówki (zabieg przeprowadzono na 255 oczach u 136 pacjentów). W tym ośrodku wykorzystywano terapię złożoną ze steroidu (który odstawiano po około 3 miesiącach), takrolimusu (stosowanego przez około rok) i mykofenolanu mofetylu (stosowanego 2-3 lata). Po średnio 4,5 roku obserwacji 77 proc. pacjentów miało prawidłową powierzchnię oka. Autorzy podkreślili, że stosowany w ich ośrodku protokół jest skuteczny i bezpieczny, nie odnotowano żadnych przypadków nowotworzenia czy zgonów, a odpowiednio długa obserwacja przez lekarza okulistę i transplantologa powoduje, że ryzyko wystąpienia nieodwracalnych działań niepożądanych spowodowanych ogólną immunosupresją w tej grupie chorych jest minimalne.
W naszym ośrodku również stosujemy trójlekową immunosupresję u pacjentów po przeszczepie rąbkowym rogówki, na którą składa się steroid, cyklosporyna A i mykofenolan mofetylu. Zgodnie z zasadami przyjętymi w transplantologii, leki odstawiane są stopniowo. Po około 2 miesiącach redukujemy dawkę steroidu, następnie po około roku odstawiana jest cyklosporyna, a mykofenolan mofetylu i steryd w małej dawce stosowane są przez 2-3 lata i w przypadku dobrej odpowiedzi biorcy leczenie jest zakończone. Podobnie jak w przypadku przeszczepów drążących przez pierwsze 6 miesięcy podawany jest profilaktycznie antybiotyk i lek przeciwwirusowy (według schematu opisanego powyżej).
Podsumowując, dzięki zastosowaniu ogólnych leków immunosupresyjnych u biorców rogówki wysokiego ryzyka znacznie wydłużył się okres utrzymania przezierności przeszczepu i zmniejszyła się częstość występowania ostrego odrzucania w tej grupie chorych.
tekst prof. Jacek P. Szaflik1,2, prof. Mieczysław Lao2, dr n. med. Joanna Major2, prof. Jerzy Szaflik1,2
1Katedra i Klinika Okulistyki II Wydziału Lekarskiego Warszawskiego Uniwersytetu Medycznego, 2Samodzielny Publiczny Kliniczny Szpital Okulistyczny w Warszawie
Piśmiennictwo
1. Birnbaum F., Mayweg S., Reis A., Böhringer D., Seitz B., Engelmann K., Messmer E.M., Reinhard T.: Mycophenolate mofetil (MMF) following penetrating high-risk keratoplasty: long-term results of a prospective, randomised, multicentre study. Eye (Lond). 2009 Nov; 23 (11): 2063-70).


 Instytut Nagrody Zaufania Złoty OTIS
Instytut Nagrody Zaufania Złoty OTIS