Śródoperacyjny zespół wiotkiej tęczówki – o czym warto pamiętać?
Śródoperacyjny zespół wiotkiej tęczówki jest rzadkim zespołem zwiększającym ryzyko wystąpienia poważnych powikłań śródoperacyjnych. Jeśli nie zostanie wdrożone odpowiednie postępowanie, zespół ten przedłuża i komplikuje operację zaćmy.
PROF. DR HAB. N. MED. JACEK P. SZAFLIK 1,2 | LEK. TOMASZ GAŁECKI 2
1 – KATEDRA I KLINIKA OKULISTYKI II WYDZIAŁU LEKARSKIEGO WARSZAWSKIEGO UNIWERSYTETU MEDYCZNEGO | 2 – SAMODZIELNY PUBLICZNY KLINICZNY SZPITAL OKULISTYCZNY W WARSZAWIE
Śródoperacyjny zespół wiotkiej tęczówki (Intraoperative Floppy Iris Syndrome, IFIS) to zespół pierwszy raz opisany w 2005 roku przez Changa i Campbella, na który składa się triada objawów. Są to: falowanie tęczówki podczas operacji, wypadanie tęczówki przez porty oraz postępujące podczas operacji zaćmy zwężanie źrenicy.
IFIS występuje w 1-2,2% wszystkich operacji zaćmy. Wśród pacjentów przyjmujących tamsulozynę częstość jest znacznie większa i sięga nawet 90% (od 37,9 do 90%) [1, 2, 3].
Do głównych mechanizmów odpowiedzialnych za powstawanie IFIS należą: anatomiczne zmiany mięśnia rozwieracza źrenicy, deinerwacja mięśnia rozwieracza źrenicy oraz dysfunkcja unaczynienia tęczówki.
Etiologia zespołu jest wieloczynnikowa, ale największy związek występuje z przyjmowaniem ogólnym α1a agonistów, a zwłaszcza tamsulozyny. Występują trzy typy receptorów adrenergicznych α1: α1a, α1b, α1d. Receptory α1 adrenergiczne występują w mięśniówce gładkiej: gruczołu krokowego, ujścia pęcherza moczowego oraz mięśnia rozwieracza źrenicy.
Łagodny rozrost gruczołu krokowego (benign prostatic hyperplasia, BPH) to choroba występująca u mężczyzn związana głównie z rozrostem komórek gruczołowych i podścieliska gruczołu krokowego, powodująca zwężenie drogi odpływu moczu. Występuje u ponad 50% mężczyzn w wieku > 60. r.ż, i prawie 90% powyżej 85. r.ż. Jest przyczyną zaburzeń funkcji dolnych dróg moczowych (lower urinary tract symptoms, LUTS), powstania przeszkody podpęcherzowej oraz związanych z tym objawów utrudnienia w oddawaniu moczu. Stosując leki blokujące α1 zmniejsza się napięcie w szyi pęcherza moczowego, w gruczole krokowym, w cewce moczowej. Antagoniści α1 receptorów adrenergicznych pozwalają na odroczenie zabiegu operacyjnego dzięki zmniejszeniu przeszkody podpęcherzowej, a co za tym idzie, znacznym złagodzeniu objawów dysurycznych.
Wśród leków, które mogą wywoływać zespół wiotkiej tęczówki należą: antagoniści receptorów α adrenergicznych: α1-blokery (tamsulozyna, alfuzosyna, terazosyna), nieselektywne α-blokery (doksazosyna, prazosyna), α i β-blokery (carvedilol, labetalol), antagoniści presynaptyczni α1 (mianseryna) oraz rzadziej benzodiazepiny, neuroleptyki (chlorpromazyna, haloperidol, kwetiapina), inhibitor 5α-reduktazy (finasteryd), rywastygmina, pochodne alkaloidów sporyszu (ergotamina). Długość terapii α-blokerami nie ma wpływu na występowanie IFIS. Ze względu na powszechność stosowania powyższych leków IFIS może również występować u kobiet[4].
Spośród wszystkich leków najczęściej zespół IFIS powoduje tamsulozyna. Jest ona nieodwracalnym antagonistą receptorów α1a. Badania in vitro wykazały, że tamsulozyna wykazuje 20 razy większe powinowactwo do receptorów α1a niż α1b, oraz 3 razy większe powinowactwo do α1a niż do α1d. Z tych powodów jest bardziej uroselektywna, przez co wywołuje mniej krążeniowych działań niepożądanych, ale również jest lekiem najsilniej związanym z IFIS, ponieważ w tęczówce, w mięśniu rozwieracza źrenicy głównie występują receptory α1a. Wykazano, że u pacjenta stosującego tamsulozynę wskaźnikiem możliwości wystąpienia IFIS jest średnica źrenicy po rozszerzeniu mniejsza niż 6,5 mm (p=0,032)[5]. Tamsulozyna doprowadza do trwałych zmian w tęczówce. W pośmiertnym badaniu oczu pacjentów leczonych tamsulozyną w porównaniu z grupą kontrolną wykazano: zwiększoną ilość wakuoli w komórkach mięśni, zwiotczenie mięśni rozwieracza źrenicy, ścieńczenie lub atrofie mięśni rozwieracza źrenicy, zmniejszoną ilość miofibryli w mięśniu. Zmiany te występowały nawet kilka lat po zakończeniu terapii α-blokerami[6]. Santaella i wsp. przebadali wpływ tamsulozyny na anatomię mięśnia rozwieracza źrenicy. Przebadano pośmiertnie 52 oczu, 27 mężczyzn. 27 oczu było w grupie kontrolnej, a 25 oczu było w grupie leczonej tamsulozyną. Grubość mięśnia rozwieracza źrenicy wynosiła 8.50 ± 1.61 μm w grupie kontrolnej i 6.53 ± 1.99 μm (p<0,006) w grupie tamsulozyny i była w niej istotnie mniejsza[7].
Do niedawna sądzono, że w tęczówce znajdują się dwa rodzaje receptorów α: α1a – zlokalizowane w mięśniu rozwieracza źrenicy i α1b – zlokalizowane w tętniczkach źrenicy. Wyniki ostatnich badań immunohistochemicznych i w mikroskopie elektronowym fragmentu tęczówki z zastosowaniem barwienia na miozynę mięśniówki tętniczek tęczówki, oraz barwienia na obecność receptorów α1a, wykazały wspólne występowanie miozyny i receptorów α1a, co wskazuje na lokalizację tych ostatnich na komórkach mięśniówki ściany tętniczek. Silna immunoreaktywność receptorów α1a wokół światła tętniczek u osoby nieleczonej α1-blokerami oraz zmniejszona immunoreaktywność receptorów α1a wokół światła tętniczek u osoby leczonej α1-blokerami sugeruje, że leczenie α1-blokerami prowadzi do obniżenia aktywności receptorów α1a, co jest przyczyną dysfunkcji tętniczek źrenicy, polegającej na tym, że naczynia tęczówki zatracają możliwość skręcania się w odpowiedzi na stymulację adrenergiczną, co utrudnia rozszerzanie źrenicy[8].
Ze względu na swoje charakterystyczne cechy zespół IFIS może być przyczyną wystąpienia szeregu powikłań śródoperacyjnych. Należą do nich: nieprawidłowa kapsuloreksja, przerwanie torby tylnej z upływem ciała szklistego, dyslokacja jądra soczewki do ciała szklistego, pozostawienie mas korowych, dyslokacja implantu, trudności z uszczelnieniem rany operacyjnej, uszkodzenie tęczówki, wydłużenie czasu operacji. Częściej może dochodzić do powstania pooperacyjnego obrzęku plamki.
Opracowano liczne metody zapobiegania IFIS i minimalizowania jego objawów. Do dostępnych sposobów należą: podanie miejscowo atropiny przed operacją, modyfikacja techniki fako, podanie adrenaliny/fenylefryny do komory przedniej, stosowanie retraktorów tęczówkowych, stosowanie OVD wiskoadaptacyjnych, oraz stosowanie pierścieni rozszerzających źrenicę.
Liczne badania dowiodły, że zaprzestanie podawania α1-blokerów nie zmniejsza częstości ani ciężkości IFIS, a zwiększa ryzyko nasilenia objawów LUTS. Zaprzestanie stosowania α1-blokerów nie zmniejsza częstości występowania IFIS ponieważ nawet krótkotrwała terapia tymi lekami prowadzi do remodelingu tęczówki[9].
Atropina działa mydriatycznie poprzez blokowanie przekaźnictwa cholinergicznego do mięśnia zwieracza źrenicy. W przypadku podejrzenia IFIS należy zacząć wkraplanie atropiny minimum dwa dni przed zabiegiem. Niestety atropina może zaostrzać objawy zaburzeń funkcji dolnych dróg moczowych, o czym należy poinformować pacjenta.
W przypadku możliwości wystąpienia IFIS należy zmodyfikować technikę chirurgiczną. Należy wykonać odpowiednio długi tunel rogówkowy, który będzie kończył się względnie daleko od tęczówki. Delikatna hydrodyssekcja i ustawienie niskich parametrów przepływu pozwolą na zminimalizowanie falowania tęczówki. Zastosowanie bimanualnej irygacji/aspiracji oraz stosowanie stabilizatorów komory przedniej pozwoli na zminimalizowanie ryzyka wypadania tęczówki przez porty[10].
Adrenalina jest agonistą receptorów α i działa przeciwstawnie do tamsulozyny. Po podaniu dokomorowym w trakcie operacji przywraca napięcie tęczówki, zmniejsza jej tendencję do falowania i wypadania, oraz rozszerza źrenicę. Łącznie z przedoperacyjnym podawaniem atropiny jest jednym z najskuteczniejszych sposobów zapobiegania IFIS.
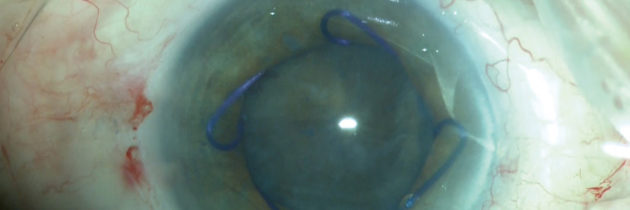
W przypadku ryzyka IFIS istnieje wiele technik mechanicznych niwelowania objawów zespołu. Wiskomydriaza poprzez zastosowanie OVD wiskoadaptacyjnych skutecznie poszerza źrenicę i odpycha tęczówkę od rogówki, niestety może powodować pooperacyjne skoki ciśnienia wewnątrzgałkowego. Retratory tęczówkowe stosowane są przy wąskiej źrenicy. W trakcie całego zabiegu utrzymują jednakową średnicę źrenicy i zapobiegają wypadaniu tęczówki. Rekomendowane jest stosowanie czterech retraktorów w układzie karo, co jednak wymaga wykonania czterech dodatkowych nacięć rogówki. Pierścienie poszerzające źrenicę również stosowane są przy wąskiej źrenicy. Utrzymują przez cały zabieg jednakową średnicę źrenicy i zapobiegają wypadaniu tęczówki, ale są mniej traumatyczne od retraktorów, i nie wymagają stosowania dodatkowych nacięć.
W ankiecie przeprowadzonej przez amerykańskie towarzystwo chirurgii zaćmy i chirurgii refrakcyjnej większość chirurgów, którzy doświadczyli IFIS stosowało łącznie więcej niż jedną z wyżej wymienionych technik. Jako najważniejszą rzecz w zapobieganiu powikłań związanych z IFIS wskazali prawidłowo zebrany wywiad, z którego dowiadywali się o przyjmowaniu leków mogących doprowadzić do wystąpienia zespołu.
IFIS jest rzadkim zespołem, zwiększającym ryzyko wystąpienia poważnych powikłań śródoperacyjnych. Jest głównie spowodowany blokadą receptorów α1a występujących w mięśniu rozwieracza źrenicy. Jeśli nie zostanie wdrożone odpowiednie postępowanie, IFIS przedłuża i komplikuje operację zaćmy. Zaprzestanie podawania α1 blokerów nie zmniejsza częstości ani ciężkości IFIS, a zwiększa ryzyko nasilenia objawów LUTS. Opracowano strategie postępowania minimalizujące ryzyko powikłań, które można stosować łącznie, ale najważniejszy jest prawidłowo zebrany wywiad. Lekarze pierwszego kontaktu, okuliści, urolodzy powinni być świadomi związku między stosowaniem α1-blokerów, a także innych leków z występowaniem IFIS.
Piśmiennictwo:
1. Chadha V., Borooah S., Tey A. et al. Floppy iris behaviour during cataract surgery: associations and variations. Br. J. Ophthalmol. 91(1), 40–42 (2007)
2. Neff K.D., Sandoval H.P., Fernández et al. Factors associated with intraoperative floppy iris syndrome. Ophthalmology 116, 658–663 (2009).
3. Nguyen D.Q., Sebastian R.T., Kyle G. Surgeon’s experiences of the intraoperative floppy iris syndrome in the United Kingdom. Eye 21(3), 443–444 (2007)
4. Chatziralli I.P., Peponis V., Parikakis E., Maniatea A., Patsea E., Mitropoulos P.; Risk factors for intraoperative floppy iris syndrome: a prospective study. Eye (Lond) 2016 Aug;30(8):1039-44. doi: 10.1038/eye.2016.122. Epub 2016 Jul 1
5. Chen A.A., Kelly J.P., Bhandari A., Wu M.C. Pharmacologic prophylaxis and risk factors for intraoperative floppy-iris syndrome in phacoemulsification performed by resident physicians. J Cataract Refract Surg 2010;36:898-905.
6. Prata T.S., Palmiero P.M., Angelilli A., et al. Iris morphologic changes related to alpha one adrenergic receptor antagonists: implications for floppy iris syndrome. Ophthalmology 2009;116:877-881.
7. Santaella R.M., Destafeno J.J., Proia A.D., Chang D.F., Kim T. The effect of α1-adrenergic receptor antagonist tamsulosin (Flomax) on iris dilator smooth muscle anatomy. Ophthalmology. 2010;117:1743–1749
8. Panagis L., Basile M., Friedman A.H., Danias J.; Intraoperative Floppy Iris Syndrome Report of a Case and Histopathologic Analysis. Arch Ophthalmol. 2010;128(11):1437-1441. doi:10.1001/archophthalmol.2010.243
9. Chang D.F., Osher R.H., Wang L et al. Prospective multicenter evaluation of cataract surgery in patients taking tamsulosin (Flomax). Ophthalmology 114(5), 957–964 (2007)
10. Ahmed Sallam; Hany El-Defrawy; Adam Ross; Samer J. Bashir; Hamish M.A. Towler; Review and Update of Intraoperative Floppy Iris Syndrome; Expert Rev Ophthalmol. 2011;6(4):469-476.





 Instytut Nagrody Zaufania Złoty OTIS
Instytut Nagrody Zaufania Złoty OTIS