Zasady kontroli i postępowania po leczeniu nowotworów narządu wzroku
prof. dr hab. n. med. Bożena Romanowska-Dixon 1, 2 | lek. Barbara Jakubowska 2, dr n. med. Anna Markiewicz 1, 2 | lek. Joanna Kowal 2 | lek. Magdalena Dębicka-Kumela 1, 2, | dr n. med. Anna Bogdali 1, 2
1Katedra i Klinika Okulistyki i Onkologii Okulistycznej Wydziału Lekarskiego Uniwersytetu Jagiellońskiego Collegium Medicum w Krakowie | 2Oddział Kliniczny Okulistyki i Onkologii Okulistycznej Szpitala Uniwersyteckiego w Krakowie
Pacjenci po leczeniu z powodu nowotworów narządu wzroku powinni pozostawać przez całe życie pod opieką okulisty i onkologa, w zależności od rodzaju leczonego nowotworu.
Nowotwory powiek
Najczęstszym nowotworem powiek jest miejscowo złośliwy rak podstawnokomórkowy. Złośliwe nowotwory powiek usuwamy chirurgicznie z marginesem niezmienionych tkanek. Po wycięciu oznakowany szwem materiał przesyłany jest do śródoperacyjnego badania histopatologicznego. W przypadku niecałkowitego wycięcia, usuwane są obszary tkanek, w których stwierdzono obecność nowotworu. Rekonstrukcja powiek jest możliwa dopiero wtedy, kiedy nie stwierdza się obecności komórek nowotworowych w marginesach i dnie ubytku. (Ryc. 1.)
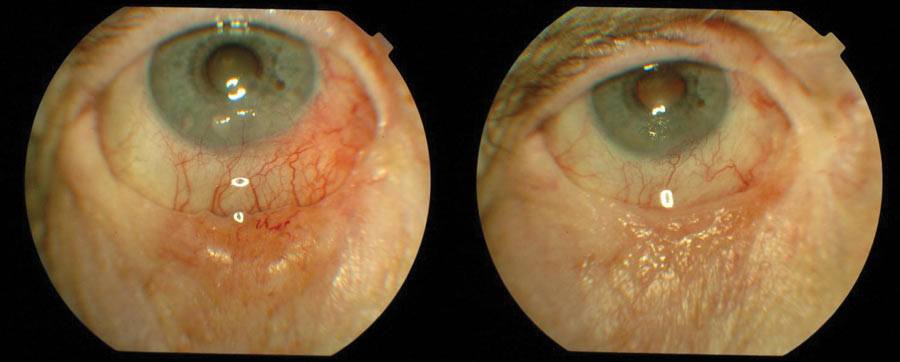
Ryc. 1. Rak podstawnokomórkowy przed i po leczeniu.
Podczas kontrolnych badań oceniany jest efekt funkcjonalny, estetyczny i ewentualne wystąpienie wznowy procesu nowotworowego. W razie nieprawidłowości kosmetycznych konieczne jest wykonanie naprawczych zabiegów operacyjnych, a w przypadkach wznowy wycięcie nowotworu z histopatologicznym badaniem śródoperacyjnym.
Wznowa brzeżna raka podstawnokomórkowego powiek jest widoczna we wczesnej fazie wzrostu, natomiast wznowa w głębokich tkankach, zwłaszcza w kącie wewnętrznym oka rozrasta się pod blizną i ma tendencję do naciekania oczodołu. W tej sytuacji wskazane jest wykonanie badań obrazowych ułatwiających podjęcie decyzji o sposobie leczenia i zastosowanie radykalnego zabiegu chirurgicznego wycięcia guza lub wypatroszenia oczodołu, a w przypadku nieoperacyjnych nowotworów (ze względu na stan zaawansowania, naciekanie kości i innych struktur) napromienianie.
Nowotwory spojówki
Najczęstszymi złośliwymi nowotworami spojówki są czerniak i rak płaskokomórkowy. Złośliwe nowotwory mięska łzowego i fałdu półksiężycowatego wycinamy i w zależności od wyniku badania histopatologicznego stosujemy miejscową chemioterapię. Nowotwory spojówki gałkowej usuwamy chirurgicznie z następową brachyterapią lub miejscową chemioterapią. W przypadkach pierwotnej nabytej melanozy i zmian podejrzanych o atypię i transformację nowotworową stosujemy „mapowanie” spojówki (pobieranie wycinków z wielu miejsc zmienionej tkanki). (Ryc. 2., 3.)
Powikłaniami po leczeniu nowotworów spojówki mogą być: zespół suchego oka, niedomykalność szpary powiekowej, przymglenie rogówki, zaburzenia ruchomości gałki ocznej i inne.
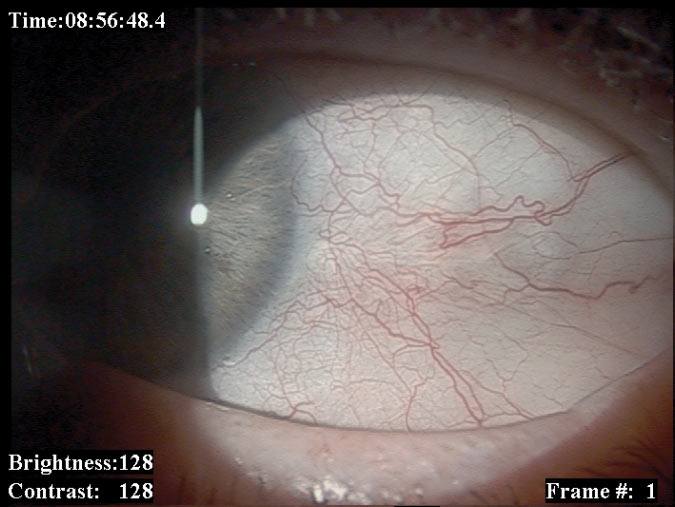
Ryc. 2. Czerniak spojówki gałkowej przed i po leczeniu.
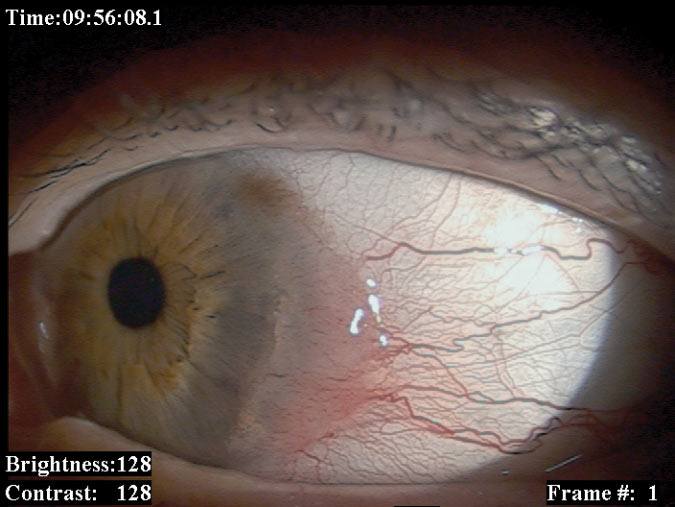
Ryc. 2. Czerniak spojówki gałkowej przed i po leczeniu.
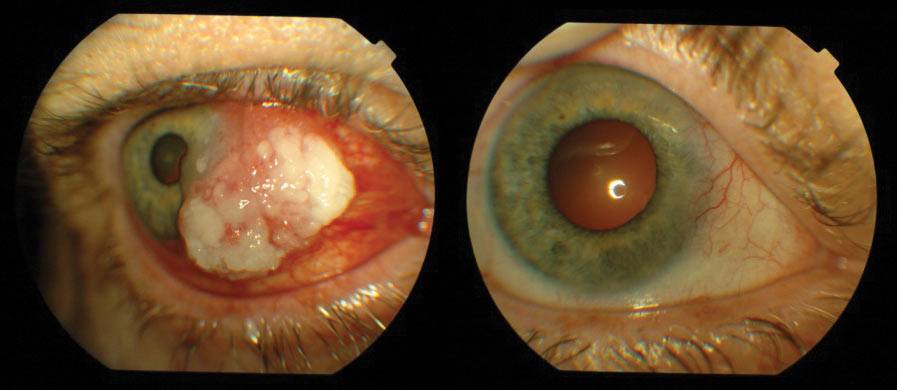
Ryc. 3. Rak płaskonabłonkowy przed i po leczeniu.
Nowotwory wewnątrzgałkowe
Czerniak błony naczyniowej
W obrębie tęczówki i ciała rzęskowego występuje czerniak złośliwy (w tym czerniak okrężny). Leczenie czerniaków tęczówki i ciała rzęskowego najczęściej polega na chirurgicznym usunięciu (jeśli wymiary i stan kliniczny na to pozwalają) i/lub leczeniu uzupełniającym za pomocą brachyterapii. Często stosowane jest wyłącznie napromienianie – brachyterapia Ru-106 lub l-125 (zależnie od grubości guza). Guzy o podstawie większej niż 15 mm nie są wycinane, lecz leczone brachyterapią. Jeśli niemożliwe jest zastosowanie wyżej wymienionych metod z powodu zbyt dużej wysokości guza lub jego podstawy oraz wystąpienia jaskry wtórnej, wówczas należy rozważyć usunięcie gałki ocznej.
Po wycięciu guza tęczówki i/lub ciała rzęskowego w początkowym okresie pooperacyjnym stosujemy: mydriatyki, antybiotyk ze sterydem, leki ochraniające rogówkę, a w przypadku podwyższonego ciśnienia wewnątrzgałkowego leki przeciwjaskrowe, leki przeciwkrwotoczne oraz zalecamy oszczędzający tryb życia. Szwy rogówkowe usuwamy najwcześniej po 3 miesiącach, jeśli nie są przykryte spojówką. Podczas badań kontrolnych po wycięciu czerniaka tęczówki i ciała rzęskowego wskazane jest wykonanie badania gonioskopowego i badania UBM w celu oceny stanu miejscowego i wymiarów guza resztkowego lub obszaru ubytku pooperacyjnego pod kątem oceny ewentualnej wznowy. Ważna jest także, zwłaszcza w przypadku guzów ciała rzęskowego, ocena stanu dna oka po poszerzeniu źrenicy ze względu na możliwość wystąpienia guza naczyniówki. (Ryc. 4., 5.)
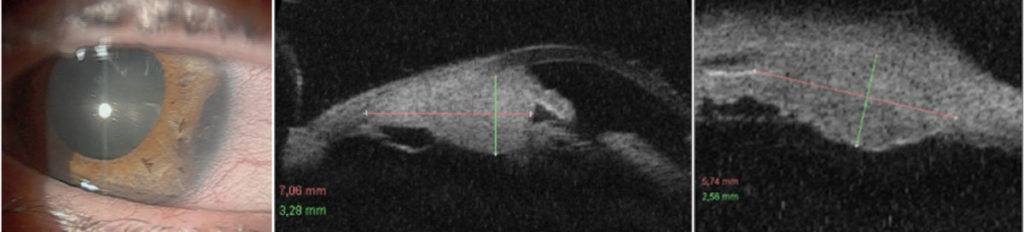
Ryc. 4. Czerniak ciała rzęskowego przed i po leczeniu brachyterapią.

Ryc. 4. Czerniak ciała rzęskowego przed i po leczeniu brachyterapią.
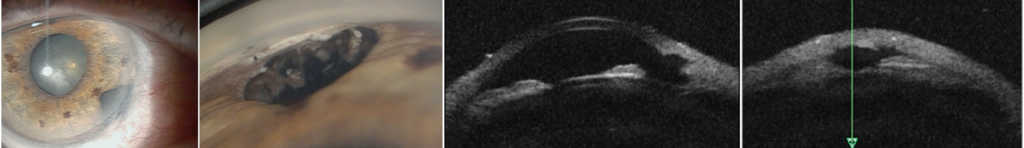
Ryc. 5. Stan po wycięciu czerniaka tęczówki.
W leczeniu czerniaka naczyniówki stosujemy następujące metody: radioterapię przy użyciu aplikatorów (Ru-106 i I-125) naszywanych na twardówkę (brachyterapia) lub teleradioterapię np. wiązką protonów, wycięcie metodą endo- lub egzoresekcji i enukleację. Skuteczność leczenia miejscowego czerniaka naczyniówki jest wysoka (ponad 90%). (Ryc. 6.)
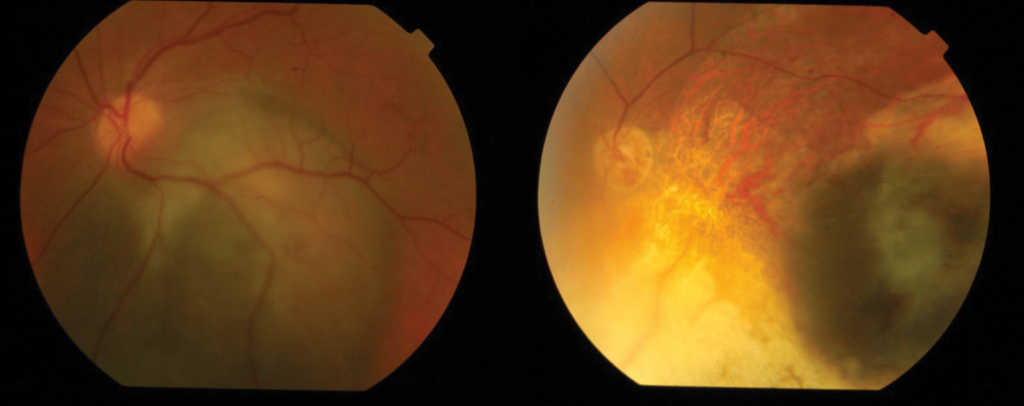
Ryc. 6. Czerniak naczyniówki przed i po leczeniu brachyterapią Ru-106.
Postępowanie po leczeniu pacjenta, to kontrola stanu miejscowego: badanie dna oka po poszerzeniu źrenicy, badanie ultrasonograficzne (USG – 10 do 20 MHz dla guzów tylnego odcinka oka lub UBM – 35 do 50 MHz stosowane w guzach ciała rzęskowego i tęczówki) oraz zalecanie kontrolnych badań systemowych (prób wątrobowych, USG lub KT jamy brzusznej co 3 do 6 miesięcy i rentgenowskie badanie płuc (RTG) raz w roku).
Popromienne powikłania mogą być leczone w rejonie zamieszkania: w przypadku retinopatii należy wykonywać laserokoagulację siatkówki, doszklistkowe iniekcje preparatów anty-VEGF lub steroidów i/lub chirurgicznie: usunięcie zaćmy, operacje przeciw jaskrowe, witrektomię.
Wszyscy pacjenci leczeni z powodu złośliwych nowotworów wewnątrzgałkowych w krakowskiej Klinice Okulistyki i Onkologii Okulistycznej Szpitala Uniwersyteckiego są okresowo kontrolowani do końca życia. Pierwsza kontrola odbywa się po 4-6 miesiącach, kolejna po roku, następnie co 2 lata od leczenia. Wskazane jest wykonywanie w rejonie zamieszkania chorego okulistycznych i ultrasonograficznych badań kontrolnych w okresie pomiędzy wizytami w naszej klinice. Konieczne jest także monitorowanie stanu ogólnego poprzez regularne przeprowadzanie badań, tj. USG lub KT jamy brzusznej, prób wątrobowych i RTG płuc według podawanego przy każdej kontroli schematu.
Po napromienianiu czerniaka naczyniówki obserwujemy powolne zmniejszenie masy guza, wyższą reflektywność wewnętrzną w USG, która świadczy o bliznowaceniu i zaniki siatkówkowo-naczyniówkowe wokół podstawy guza. Są to korzystne objawy świadczące o skutecznym leczeniu miejscowym. Obiektywna ocena wielkości guza możliwa jest po wykonaniu pomiarów podczas badania UBM lub/i USG (szerokości podstawy południkowej i równoleżnikowej guza oraz jego grubości bez i ze ścianą gałki ocznej). W ocenie pomiarów należy uwzględniać zarówno różnice wynikające z możliwości rozdzielczych różnych aparatów USG, jak i różnice wynikające z braku możliwości uzyskania precyzyjnej powtarzalności miejsca pomiaru. (Ryc. 7.)
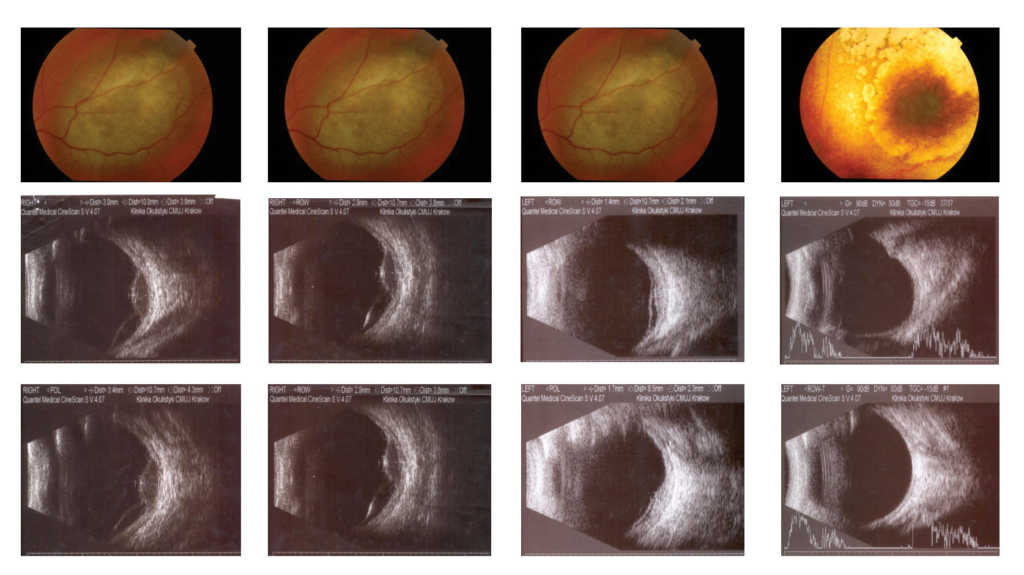
Ryc. 7. Czerniak naczyniówki przed i po brachyterapii Ru-106.
Dlatego należy wykonywać badanie mając do dyspozycji obraz wyjściowych wymiarów i kolejnych badań (wszyscy pacjenci kontrolowani w naszej klinice otrzymują każdorazowo oprócz wyniku badania kontrolnego wynik badania USG). Różnice w pomiarach dotyczące szerokości podstawy po brachyterapii wynikają z zatarcia granic podstawy guza w wyniku regresji. Różnice w pomiarach grubości guza rzędu dziesiątych części milimetra można uznać za nieistotne. Gdy różnica wynosi 1 mm lub więcej, a od brachyterapii minął miesiąc lub dwa, należy sprawdzić prawidłowość wykonania badania (porównać z badaniem poprzednim) ewentualnie powtórzyć pomiar po miesiącu.
Najczęstszymi powikłaniami po radioterapii (Ru-106, I-125 oraz terapii protonowej) czerniaka naczyniówki są: zaćma, popromienna, retinopatia i makulopatia, neuropatia, rubeoza tęczówki (jaskra neowaskularna), zespół suchego oka, odwarstwienie siatkówki, krwawienia na powierzchni guza, krwawienie do komory ciała szklistego. Rzadziej występuje stan zapalny wnętrza gałki ocznej, błony proliferacyjne i zanik gałki ocznej. Po leczeniu dużych i ogromnych czerniaków naczyniówki może wystąpić zespół toksycznego guza. Zapobiegać mu można stosując endoresekcję czerniaka po napromienianiu. Zabieg powinien być wykonany do 2 miesięcy od napromieniania, ponieważ później guz przerasta tkanką łączną i staje się twardy, jego wycięcie podczas pars plana witrektomii jest trudniejsze i obciążone większym ryzykiem krwawienia i innych powikłań.
Znaczniki tantalowe stosowane w protonowej radioterapii czerniaków naczyniówki zwykle nie są usuwane. Mogą być widoczne pod spojówką lub podczas badań obrazowych. (Ryc. 8.)
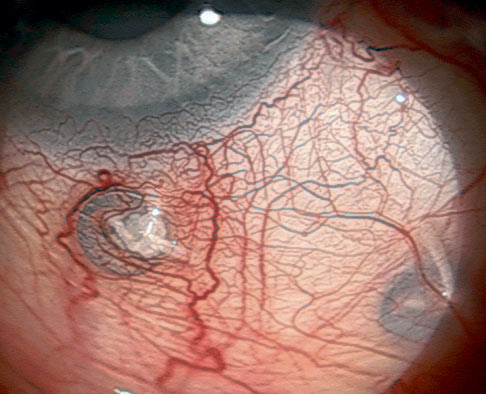
Ryc. 8. Znaczniki tantalowe widoczne pod spojówką gałkową.
W twardówce oka po napromienianiu, podczas wieloletniej obserwacji, mogą pojawić się skupiska barwnika różnej wielkości i umiejscowienia, czasem liczne. Nie mają one cech wznowy procesu nowotworowego, ani naciekania zewnątrzgałkowego i nie są niepokojącym objawem. Skupiska barwnika mogą się powiększać i może ich przybywać w okresie obserwacji. Migracja barwnika w twardówce opisywana jest w literaturze i nie stanowi wskazania do leczenia. (Ryc. 9.)
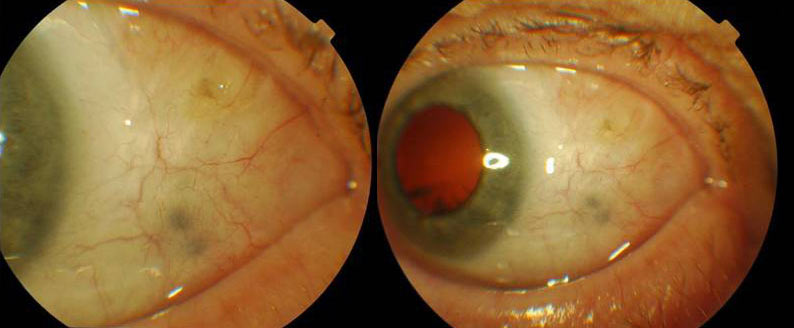
Ryc. 9. Skupiska barwnika w twardówce po napromienianiu.
Po napromienianiu guzów ciała rzęskowego obserwujemy ścieńczenie twardówki, które może sugerować rozrost zewnątrzgałkowy. W razie wystąpienia takiego objawu należy wykonać badanie UBM 35 lub 50 MHz celem oceny tego obszaru. (Ryc. 10.,11.)
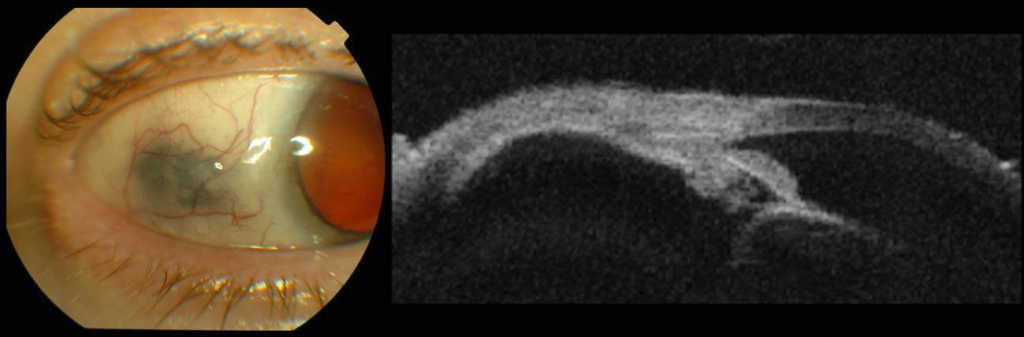
Ryc. 10. Ścieńczenie twardówki w badaniu klinicznym i UBM.
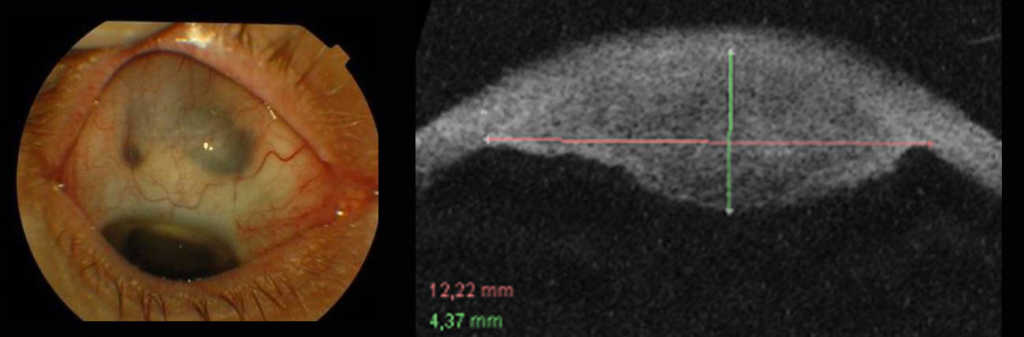
Ryc.11. Czerniak ciała rzęskowego naciekający twardówkę.
Oko z czerniakiem zbyt dużym, aby go napromienić czy wyciąć lub umiejscowionym na tarczy nerwu II kwalifikuje się do enukleacji. Podczas tej operacji wszczepiany jest implant oczodołowy, nad którym zszywane są mięśnie gałkoruchowe i tkanki oczodołu (torebka Tenona, spojówka). Odstępujemy od wszczepienia implantu oczodołowego w przypadku obecności nacieków zewnątrzgałkowych. W tych przypadkach stosuje się poszerzoną enukleację, w czasie której gałka oczna usuwana jest z marginesem otaczających tkanek obejmującym widoczny naciek zewnątrzgałkowy. W tej sytuacji konieczne są częstsze badania kontrolne i wykonywanie okresowych badań obrazowych (MRI oczodołów). (Ryc. 12.)
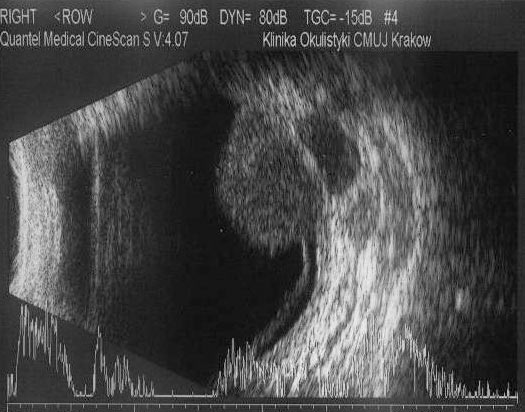
Ryc. 12. Badanie USG 10 MHz czerniaka naczyniówki z naciekiem zewnątrzgałkowym.
Po wyłuszczeniu gałki ocznej, zwłaszcza bez wszycia implantu oczodołowego może wystąpić poenukleacyjny zespół oczodołu cechujący się asymetrią twarzy, pogłębieniem bruzdy powieki górnej, dysfunkcją powiek (niedomykalność, opadnięcie) i rozciągnięciem dolnej powieki.
Wszczepienie implantu oczodołowego zapobiega powstaniu zmian anatomicznych oczodołu po usunięciu gałki ocznej. Stosujemy implant oczodołowy Guthoffa zbudowany z dwóch części: silikonowej i porowatej, hydroksyapatytowej. Struktura porowata implantu umożliwia wrastanie tkanki włóknistej i naczyń do jego wnętrza, co spaja implant z tkankami oczodołu. Całkowite unaczynienie implantu trwa około 6 miesięcy. Dzięki obecności implantu proteza oka zyskuje oparcie. Mięsień dźwigacz powieki i mięsień prosty górny pozostają w miejscach anatomicznych, co pomaga w prawidłowym ustawieniu protezy oka.
Pacjenci z wszczepionym implantem oczodołowym powinni mieć wykonywane regularne badania MRI oczodołów celem oceny zawartości oczodołu i ewentualnej wznowy procesu nowotworowego. W ocenie radiologicznej oczodołu z implantem należy uwzględnić jego budowę i właściwości wymienione powyżej. (Ryc. 13.)
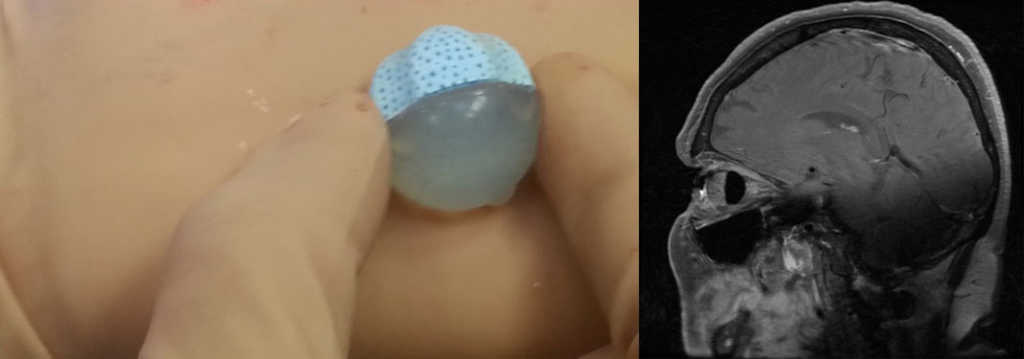
Ryc. 13. Implant oczodołowy Guthoffa przed wszyciem i prawidłowo umiejscowiony widoczny w badaniu MRI.
Oprotezowanie powinno odbywać się zaraz po usunięciu gałki ocznej ze względu na szybkie bliznowacenie tkanek. Pierwsza proteza po enukleacji (konformer) modelująca oczodół jest stosowana zaraz po wykonaniu enukleacji. (Ryc. 14.)
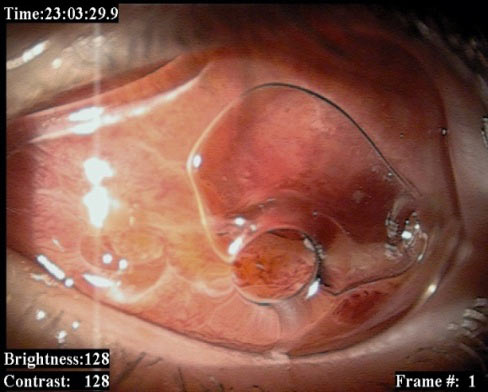
Ryc.14. Prawidłowo umiejscowiony konformer modelujący załamki spojówki pokrywającej implant.
Brak stosowania konformera może skutkować odwinięciem powieki dolnej i zanikiem załamka dolnego, co uniemożliwia dopasowanie i utrzymanie protezy oka w oczodole. (Ryc. 15.)
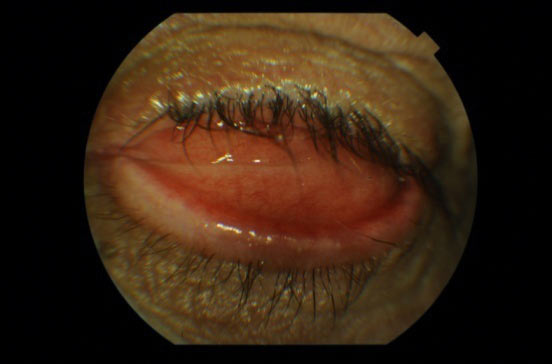
Ryc.15. Wywinięcie powieki dolnej związane z brakiem stosowania konformera.
Prawidłowe umiejscowienie konformera pozwala na przygotowanie do założenia protezy ostatecznej dzięki prawidłowemu modelowaniu oczodołu po enukleacji. (Ryc. 16.)
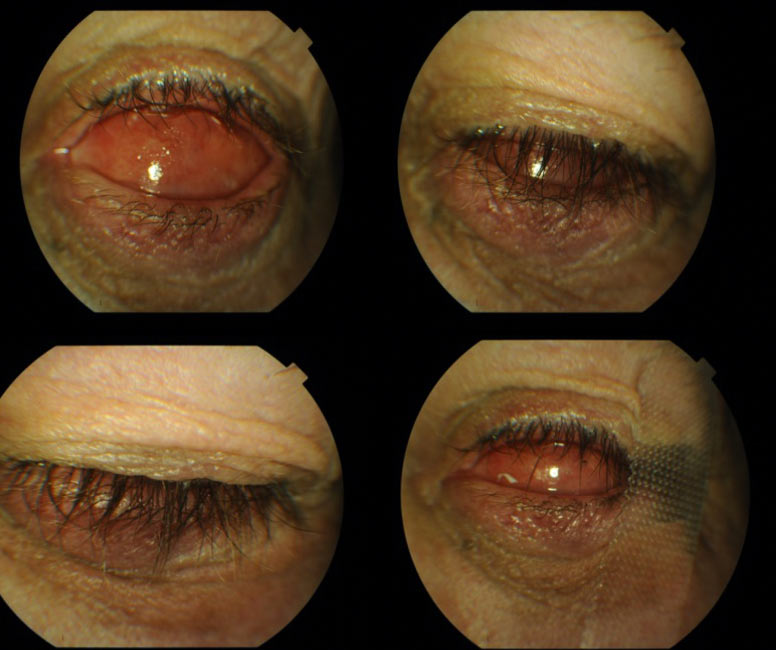
Ryc.16. Stan po prawidłowym założeniu konformera z zabezpieczeniem (plastrem) zwężającym szparę powiekową.
Protezy oka wykonywane są ze specjalistycznego szkła kriolitowego lub tworzywa sztucznego. Zalety szklanej protezy to: gładka powierzchnia, lepsza tolerancja, dobra zwilżalność powierzchni, łzy tworzą na powierzchni jednolity film. Wady to: kruchość materiału, łatwe ochładzanie (zwłaszcza w zimie), co może powodować wzmożone łzawienie oraz erozje powierzchni w związku z działaniem łez i wydzielin. (Ryc. 17.)
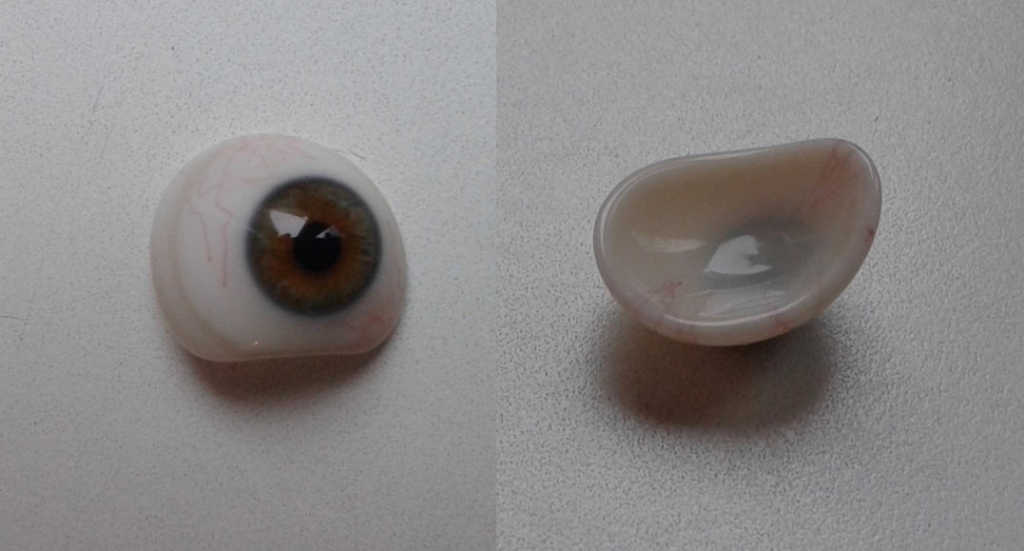
Ryc. 17. Proteza szklana.
Zaletami protezy z tworzywa sztucznego są: trwałość, stała temperatura (nie ochładza się łatwo), lekkość. Wadami są: mniej gładka powierzchnia, możliwość wystąpienia alergii i gorsze nawilżanie powierzchni. (Ryc. 18.)
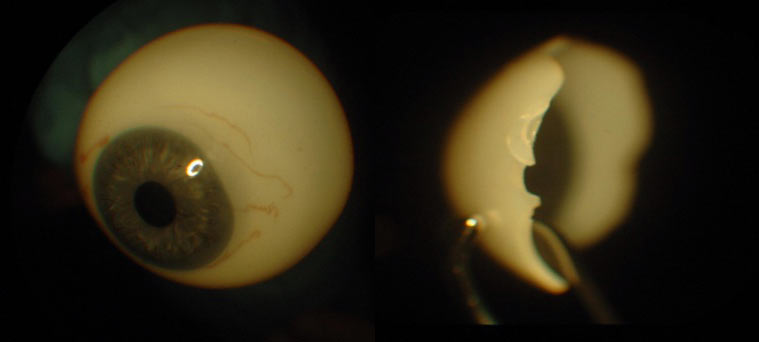
Ryc. 18. Proteza z tworzywa sztucznego.
U pacjentów z wszczepionym implantem oczodołowym ocenia się stopień ruchomości implantu.
Dobrze dobrana proteza umocowana na implancie Guthoffa umożliwia zachowanie ruchomości towarzyszącej zdrowemu oku, co daje lepszy efekt kosmetyczny ważny dla wielu pacjentów. (Ryc. 19.)
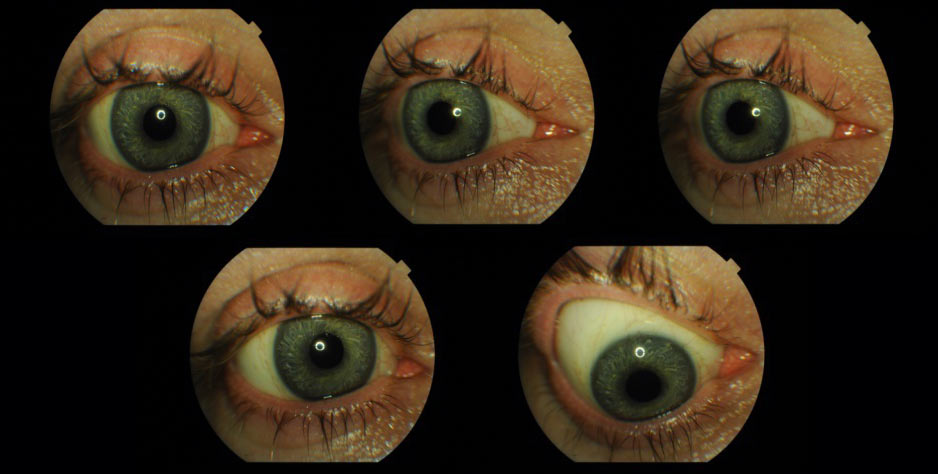
Ryc. 19. Ruchomość protezy oka umiejscowionej w oczodole z implantem oczodołowym.
Można stosować różne sposoby wyjmowania protezy:
– ręczne (pacjent kieruje wzrok ku górze, naciska palcem wskazującym dolną powiekę, aby dolny brzeg protezy uwidocznił się, delikatnie wsuwa palec wskazujący pod protezę do momentu całkowitego wysunięcia się jej z oczodołu) (Ryc. 20.),
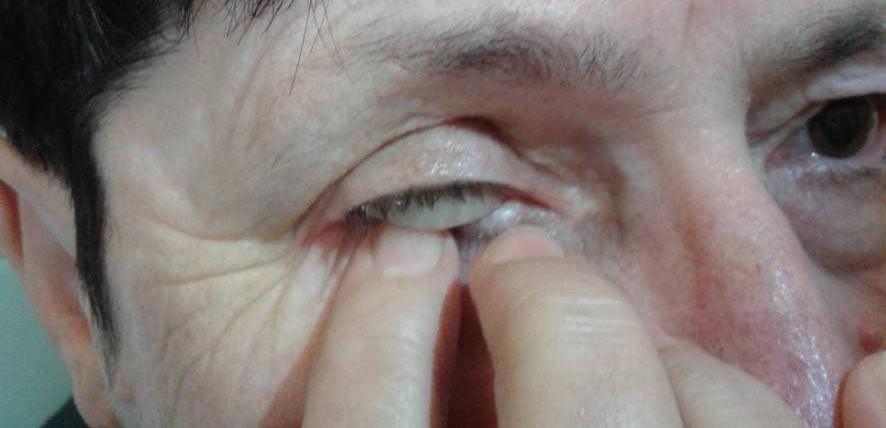
Ryc. 20. Ręczny sposób wyjmowania protezy oka.
– z użyciem szklanej szpatułki (czystą szpatułkę należy wsunąć pomiędzy dolną powiekę a dolny brzeg protezy, delikatnie podważyć i wysunąć z oczodołu). (Ryc. 21.)
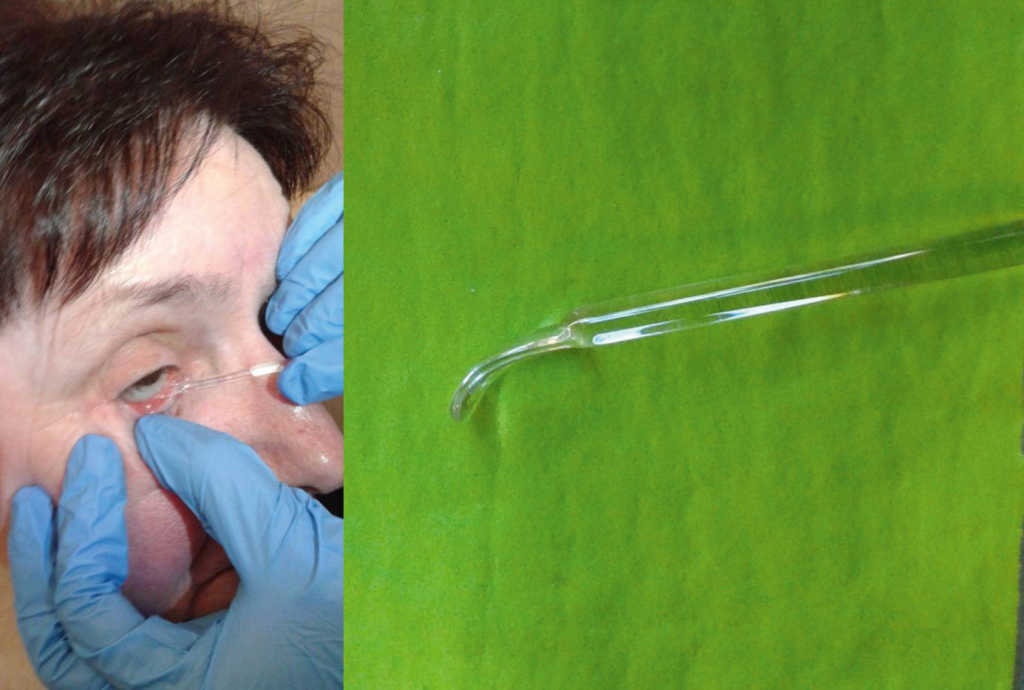
Ryc. 21. Usuwanie protezy oka za pomocą szklanej szpatułki.
– z użyciem przyssawki („przyssać” protezę i wyjąć ją, zaczynając od wysunięcia dolnego brzegu). Należy zabezpieczyć protezę przed upuszczeniem jej przez badającego przez użycie miski nerkowatej. (Ryc. 22.)
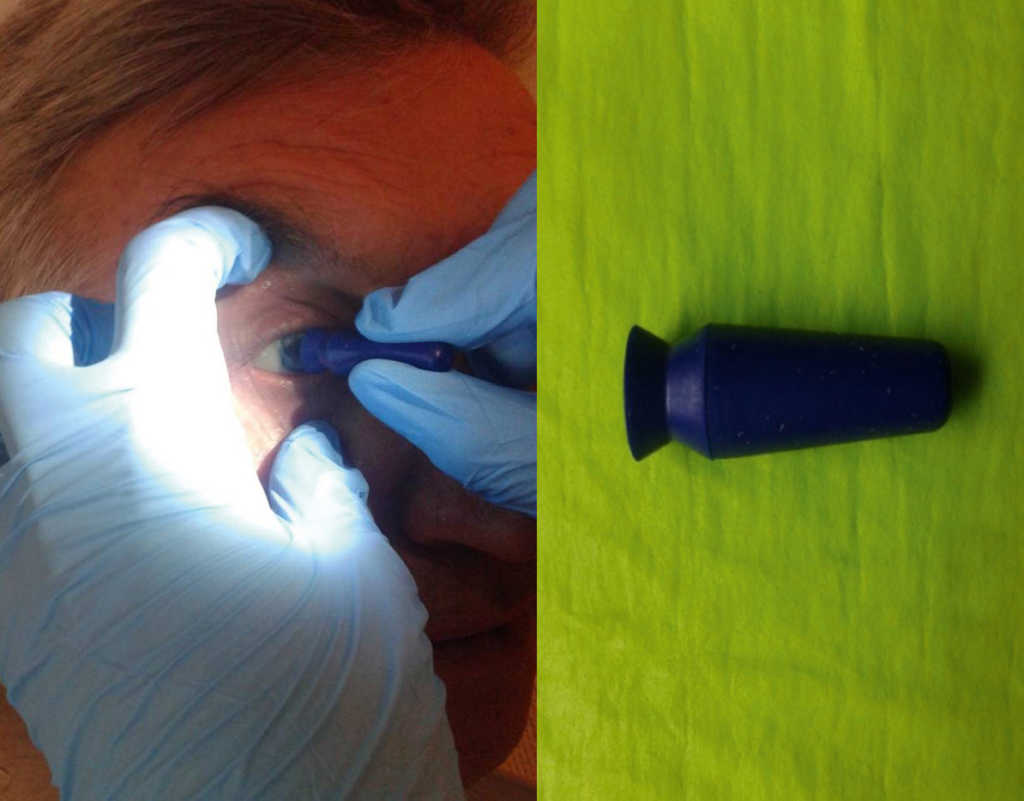
Ryc. 22. Usuwanie protezy oka za pomocą przyssawki.
Codziennie należy wykonywać toaletę oczodołu z protezą poprzez płukanie oczodołu solą fizjologiczną oraz założenie protezy po uprzednim jej oczyszczeniu i wypłukaniu solą fizjologiczną.
Oglądanie oczodołu jest ważnym elementem badania okulistycznego u chorych po usunięciu gałki ocznej. Należy też badać okoliczne węzły chłonne.
Badanie oczodołu obejmuje ocenę wyglądu spojówki wyścielającej oczodół (obecność wydzieliny, zmiana wyglądu spojówki), badanie palpacyjne oczodołu bez implantu w celu wykrycia ewentualnych twardych mas guza i oporu tkanek patologicznych. (Ryc. 23.)
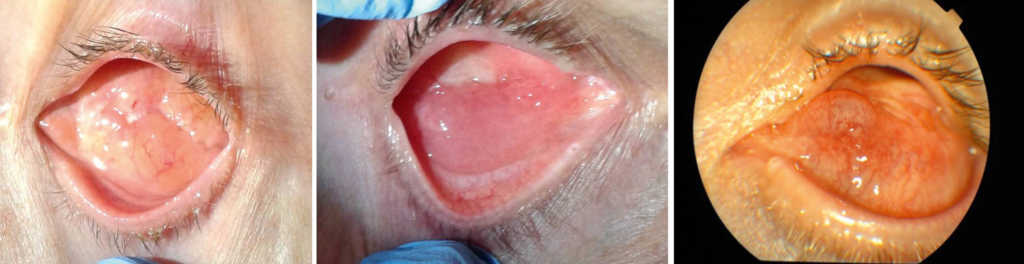
Ryc. 23. Prawidłowy wygląd spojówki oczodołu po wyłuszczeniu gałki ocznej z wszyciem implantu oczodołowego.
Stwierdzenie nieprawidłowości w obrębie spojówki oczodołu wymaga pobrania wycinka tkanki i badania histopatologicznego. Dotyczy to zwłaszcza pacjentów po poszerzonej enukleacji, którym nie wszczepiono implantu z powodu stwierdzenia makroskopowych zmian o charakterze nacieku nowotworowego. (Ryc. 24.)
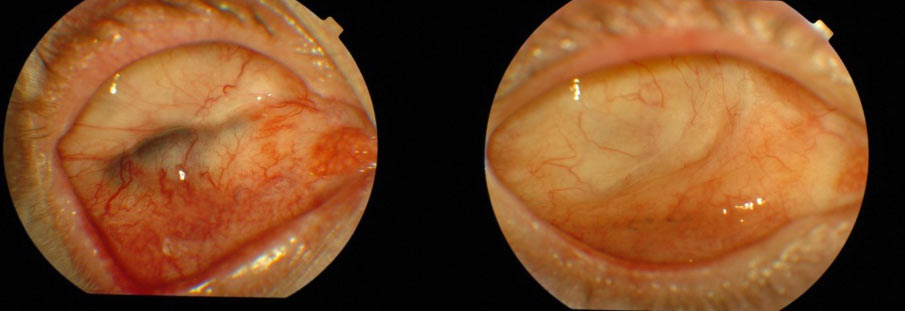
Ryc. 24. Zmiany barwnikowe w obrębie spojówki oczodołu.
Guzy przerzutowe
Przerzuty naczyniówkowe pochodzą najczęściej z raka sutka lub raka płuc, ale ogniskiem pierwotnym może być każdy nowotwór złośliwy o różnym umiejscowieniu. Przerzuty mogą być pojedyncze lub mnogie w jednym lub w obu oczach. Pojawiają się zwykle w zaawansowanym stanie choroby nowotworowej, mogą im towarzyszyć przerzuty w innych narządach. Decyzję o leczeniu miejscowym podejmujemy po wcześniejszym leczeniu systemowym (chemioterapia, hormonoterapia). Leczenie jest mniej agresywne niż w przypadku czerniaka naczyniówki. Stosujemy przezźreniczną termoterapię (TTT) lub brachyterapię guzów wewnątrzgałkowych. Enukleację wykonujemy jedynie w ogromnych guzach z jaskrą wtórną (bolesne i niewidzące oko). W przypadku rozlanych guzów, występujących w obu oczach, należy rozważyć teleradioterapię w ośrodku onkologicznym. Częstość badań kontrolnych zależy od stanu ogólnego pacjenta. Zalecana jest współpraca z lekarzem onkologiem prowadzącym chorego. (Ryc. 25.)
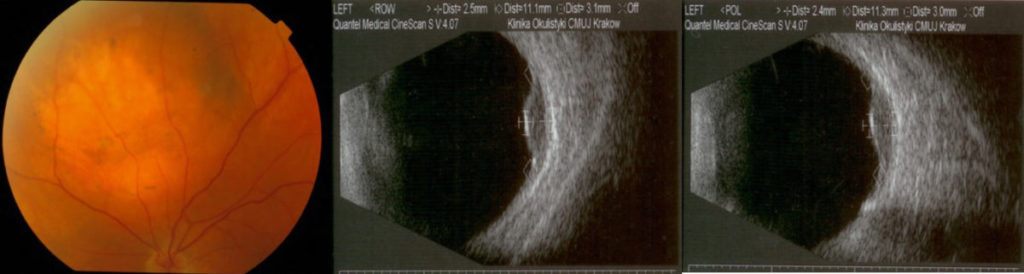
Ryc. 25. Przerzut raka sutka do naczyniówki.
Naczyniak naczyniówki
Postępowanie w przypadku rozpoznania ograniczonego naczyniaka naczyniówki zależy od jego wpływu na ostrość wzroku pacjenta. Jeśli nie powoduje pogorszenia widzenia wystarczy obserwacja. Leczenie należy rozpocząć, gdy naczyniak jest przyczyną pogorszenia ostrości wzroku. Najczęściej ograniczone naczyniaki naczyniówki umiejscowione są w tylnym biegunie, w pobliżu lub pod centralną siatkówką. Jeśli następuje pogorszenie ostrości wzroku lub występuje zagrożenie pogorszenia ostrości wzroku z powodu obecności płynu podsiatkówkowego, można zastosować terapię fotodynamiczną (PDT), a w grubszych guzach przezźreniczną termoterapię (TTT) lub brachyterapię. Postępowanie po leczeniu polega na stosowaniu leków poszerzających źrenicę i leków przeciwzapalnych przez tydzień po PDT i TTT, lub przez miesiąc po brachyterapii. Po leczeniu wskazana jest obserwacja kliniczna i ultrasonograficzna oraz zaleca się badanie optycznej tomografii koherentnej (OCT) siatkówki centralnej. Naczyniaki naczyniówki rosną zwykle powoli. Dalsze pogorszenie ostrości wzroku wymaga rozważenia ponownego leczenia. (Ryc. 26.)
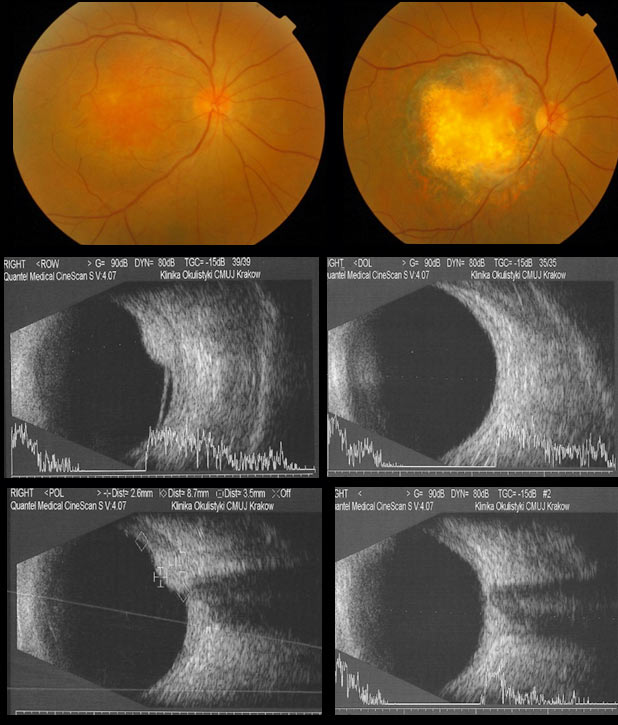
Ryc. 26. Ograniczony naczyniak naczyniówki przed i po leczeniu.
Konkluzja
Długoterminowa opieka okulisty nad pacjentami po leczeniu guzów nowotworowych oka i jego przydatków jest konieczna w związku z możliwością nawrotów miejscowych choroby. Opieka onkologiczna, w przypadku nowotworów przerzutujących, jest wskazana w związku z możliwością pojawienia się przerzutów w odległych narządach.

 Instytut Nagrody Zaufania Złoty OTIS
Instytut Nagrody Zaufania Złoty OTIS